Электролиз ржавчины — метод очистки оптимальный по затратам, доступности, эффективности даже в домашних условиях.
Электролиз — процесс пропускания электрического тока через водный раствор. На электродах при этом протекают электрохимические реакции. В нашем случае такие реакции способствуют быстрому отслоению ржавчины на границе неповрежденного металла.
Необходимые материалы/оборудование для электролиза коррозии:
- Емкость, позволяющая полностью погрузить деталь в раствор. Удобнее использовать пластиковую тару — размером от обыкновенного ведра до еврокуба…
- Источник постоянного тока. Самый доступный — блок питания персонального компьютера. Оптимальный — зарядное устройство автомобильных аккумуляторов.
- Электрические провода и металлические пластины (можно использовать куски жести);
- Вода и кальцинированная сода ( Na₂CO₃ карбонат натрия) — доступное дешевое санитарное средство очистки.
Очищаемая деталь выступает отрицательным электродом (катодом). Подключается к минусу источника тока.
Положительным электродом (анодом) служит расходный металл (например, пластина жести). Подключается к плюсу источника тока.
Анод и катод соприкасаться не должны!

Кальцинированная сода против ржавчины
Скорость электрохимической реакции электролиза зависит от:
- площади катода, анода, их взаимного расположения;
- концентрации кальцинированной соды в воде;
- напряжения — силы тока.
Можно влиять на каждый из параметров, управляя процессом электролиза ржавчины.
Подаваемое напряжение — 12 или 5 вольт.
Оптимальная сила тока (из опыта) 3-9 ампер.
Желательно иметь подключенные вольтметр — амперметр, не допуская выход значений напряжения и силы тока за пределы максимальных для источника питания (лучше всего ориентироваться на значения пониженные на 20-30% от максимальных).
Места креплений проводов к катоду/аноду имеет смысл предварительно очистить механически, обеспечив надежность электроконтакта.

Поворотный кулак до очистки электролизом
Периодически следует извлекать деталь и механически (щеткой) отделять рыхлые слои ржавчины.

Поворотный кулак после очистки электролизом
Электрохимическая (электролиз) очистка от ржавчины. FAQ от Docent86
Казалось бы про это есть куча мануалов в сети, но есть и много подводных камней.
Поэтому я решил рассказать вам про «грабли» по которым я и не только я уже прошлись.
Спорный вопрос как правильно этот метод называется. Гидролиз или Электролиз. Поэтому я предпочитаю называть его электрохимической очисткой от ржавчины.
1) Выбор ёмкости.
Для этих целей подойдёт любая тара. Канистра от ГСМ, ведро от краски и т.п. отлично подходят!

Можно даже использовать бассейн, опустив в него кузов целиком))).
Для крупных предметов специфической формы можно сделать корыто из любого подручного материала и застелить его плёнкой. Можно использовать любую металлическую ёмкость (желательно из нержавейки). Но надо принять меры что бы деталь не касалась корпуса.
2) Выбор анода.
Для этих целей можно использовать любой электропроводный материал. Чем больше его площадь тем лучше! Если вам надо почистить пару деталей то вполне подойдёт даже кусок жести. Но на долго его не хватит. Ржавчина и раствор съедят её за неделю — две. Самой живучей оказалась нержавейка. На фото в ссылке выше видно что я использовал пластину из нержавейки выгнув из неё рамку по форме канистры. Она полностью окружает деталь, так процесс идёт намного бодрее!

Если анод будет стоять только с одной стороны, то процесс с этой стороны будет гораздо быстрее чем с противоположной, придётся постоянно переворачивать деталь.
3) Выбор источника питания.
Я перепробовал многое, начиная от блока питания светодиодных лент и заканчивая сварочным аппаратом.
Оптимальное напряжение 12 вольт. При понижении процесс замедляется, а при повышении ускорения увы не замечено.
Тут скорее важна сила тока. Чем она выше тем лучше. Но и тут есть разумный предел!
Чем выше сила тока тем быстрее протекает процесс и тем быстрее поднимается температура раствора. Но это совсем не значит что если взять две абсолютно одинаковые детали и в одной ёмкости «варить» с напряжением тком в 10 ампер* до нужного эффекта 4 часа, а во второй увеличить силу тока до 40 то деталь будет готова через час. Ещё важна выдержка!
Поэтому оптимальным для меня выбором пока оставался БП от компа. Чем мощнее тем лучше, но не надо нагружать его по полной, иначе долго не проживёт!
Да и сильно крутые блоки покупать не надо, т.к. в них умная электроника которая не даст его использовать не по назначению, будет постоянно уходить в защиту. Такая же ситуация с умными зарядками.
Но в этом году я решил уйти от капризных БП от компов и перейти на суровые трансформаторы, а именно ЯТП. Один такой с небольшой доработкой уже отработал около 30 часов, прекрасно зарекомендовав себя.
Если интересно потом сделаю про это отдельный пост)
Электролиз (очистка от ржавчины) в домашних условиях. Краткое пособие без претензии на научную ценность.
Третьего дня занимался своими новыми-старыми суппортами 54-22. В связи с отсутствием лишних средств и реальной возможности (никто не делает) отдать на пескоструйку, а так же по причине личного интереса опробовал интересный метод очистки от ржавчины черных металлов под названием электролиз.
(Кто-то может назвать его иначе, но сути не меняет).
Вскользь я описывал процесс в предыдущих записях, но так как сам при подготовке долго искал инфу, решил вывалить на вас все что мне стало известно в одной записи. Мало-ли, может кому пригодится.
1. Физика процесса. Подчинена простейшему закону гражданина Фарадея:

Как видно из формулы — чем больше ток и время его воздействия, тем больше «ржавчины» перенесет магическая сила электролиза. Из этого можно сделать два важных для нас вывода:
1. По-любому есть какая-то определенная сила тока, оптимальная для очистки. Да, она есть и лежит в пределах 4 — 10А при напряжении 12В. Установлено это экспериментально и не только мной. К тому же при использовании обычного БП от компьютера нагружать его свыше 10-12А… ну я лично не стал бы).
2. Величина тока зависит от площади анода и катода (куска металла и самой детали), а так же от плотности электролита (количества чистящего средства, погруженного в раствор). Таким образом если у вас есть только БП от компа, где ток\напряжение регулировать в стоке невозможно — меняем либо площадь, либо плотность электролита для достижения «золотого тока».
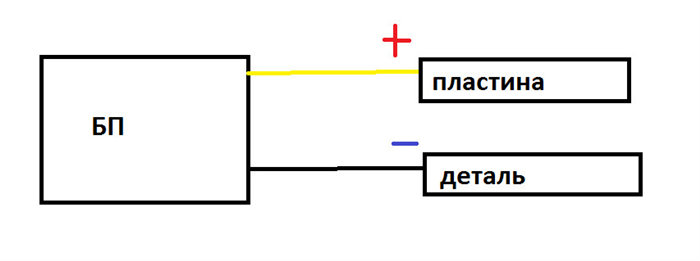
2. Схема подключения.
Ну тут все просто. Минус — на деталь. Плюс на металл. Кстати с металлом попрощайтесь заранее, если только это не нержавейка. Сожрет его ржа)
3. Материалы.
1. Понадобится в идеале емкость из нержавейки, но у меня ее нет, поэтому я использую оцинкованные ведра. Надолго их не хватает конечно.

Советую прикупить еще пластиковое ведро, ибо когда из дырок в оцинковке польется ржавая вода прямо на пол будет не очень приятно)

2. Некое вещество, которое поможет создать «очищающий элексир».
Я использовал поначалу «САНОКС». В принципе чистит хорошо, но воняет и оставляет черные окислы в местах, где было совсем уж много ржы. (Хотя возможно я не доварил).


Также пробовал «КРОТ» для очистки труб. Шляпа полная, не чистит по сравнению с САНОКСом вообще. Не рекомендую категорически.
Ну и недавно в магазине, название которого означает «пересечение нескольких дорог» рекламная пауза нашел короля электролиза — пачку кальцинированной соды.
ЛИЧНЫЙ ОПЫТ: очистка ржавчины электролизом
Соль на дорогах Беларуси зимой, конечно, позволяет ездить безопасно и с комфортом, но для кузова авто – это быстрая смерть! Особенно заметны изменения по стальным колесным дискам, комплект которых я использую зимой. Аналогичный комплект ездит и летом. Разительная разница между ними — уже через 3-4 года. Почти вся поверхность «зимних» дисков покрыта ржой, «летние» же в отличном состоянии.

Еще из школьного курса химии я знал о чудесных свойствах электролиза – процесса пропускания тока в растворах или расплавах. Электролиз привлек мое внимание своей относительной простотой и дешевизной в деле борьбы с коррозией (кто чистил ржу «болгаркой», тот поймет:). Пришлось немного почитать и вспомнить. Для очистки железных деталей решил применить раствор кальцинированной соды (карбонат натрия Na2CO3) в воде. При этом электролиз пройдет, как более щадящий метод снятия ржавчины (гидроксидов железа), чем травление кислотой.

Не вдаваясь глубоко в суть физико-химических процессов, электролиз железа в кальцинированной соде интересен тем, что он поворачивает время вспять:
— раствор NaOH и H2CO3 в нормальных условиях приведет к образованию кальцинированной соды, электролиз же инвертирует эту реакцию;
— железо в естественных условиях окисляется, а при электролизе восстанавливается;
— водород и кислород, образующиеся в процессе, стремятся соединиться как угодно: смешаться с воздухом, сгореть и стать водой, впитаться или среагировать с чем-нибудь. Электролиз же, наоборот, порождает газы различных веществ в чистом виде.

Кальцинированная сода нужна для получения угольной кислоты электролизом (H2CO3 выделяется на катоде), которая очищает металл, забирая ржавчину на себя в ускоренном темпе. Таким образом, электролизом снимается грубая ржавчина. Черный налет на железе после электролиза — оксид железа FeO (основной оксид не реагирует ни с кислотой, ни с едким натром), а также Fe2O3. Лимонной или щавелевой кислотой можно дотравить FeO, затем деталь омыть содовым раствором (Na2CO3), и получится почти чистое железо. После промывки можно поверхность протереть спиртом (спирт хорошо связывает воду). Если не ополоснуть металл и поставить сушиться, получится тоненький слой ржавчины. Поэтому после спирта есть немного времени на конечную обработку поверхности.
Теоретические выкладки изложил (в моем понимании). Если где-то ошибся, конструктивная критика приветствуется.

На практике пользовался тем, что было под рукой. В качестве анода (положительного электрода) использовал кусок жести. Катод (отрицательный электрод) – ржавый колесный диск под очистку. Место подключения провода на катоде очистил механически до чистого металла для лучшей проводимости. В качестве емкости использовал пластиковый таз из хозяйственного магазина под размер диска (стоил около 15$). Блок питания использовал маломощный для лабораторных практикумов (за неимением под рукой другого), о чем впоследствии пожалел: спалил диодный мост, пришлось восстанавливать. Поэтому лучше по-моему (в сочетании дешево-сердито) приобрести блок питания от системного блока компьютера, что намереваюсь сделать в следующий раз. Кальцинированную соду, пищевую соду и чистящее средство с щавелевой кислотой купил в ближайшем магазине, стоило все копейки.
Очистка ржавчины электрохимическим способом и гальваническая оцинковка металла. Часть 1.
Здравствуйте.
Кому лень читать много текста — в конце есть краткий ИТОГ.
ЧАСТЬ №1.
——————-
КРАТКО О СТАТЬЕ: попробовал очистить ржавчину с применением различных химикатов и электричества. После попробовал гальваническую оцинковку металла.
——————-
Заинтересовал метод электрохимической очистки ржавчины и гальваническое цинкование металла применительно к кузову автомобиля, когда нет возможности снять деталь и поместить её в гальваническую ванну. Перед тем как попробовать на практике, проштудировал интернет на эту тему и был разочарован. В сети на первый взгляд много статей, но при ближайшем рассмотрении оказалось, что публикуется одна и та же статья, немного изменённая на каждом сайте, чтобы скрыть плагиат. К тому же, в интернете есть противоречивая информация, например, на одних сайтах пишут:
Нельзя применять уничтожители ржавчины, т.к. они образовывают плёнку из фосфатов, которая будет препятствовать последующему цинкованию. Вместо них нужно применять ортофосфорную кислоту.
При этом в других источниках пишут:
Ортофосфорную кислоту для очистки ржавчины тоже применять нельзя.
На drive2 конечно есть полезные статьи на эту тему, тем не менее после долгих поисков и чтения различных форумов, так и не смог найти ответы на некоторые вопросы, поэтому решил сам попробовать различные варианты и материалы и выбрать для себя что-то одно, с чем и буду работать дальше.
И хоть результат моего эксперимента оказался не вполне завершённым, некоторые вопросы и сомнения всё же были разрешены. Итак.
Кратко, суть метода электрохимической очистки ржавчины и гальванического цинкования металла: уничтожаем ржавчину разъедающими химикатами и одновременно пропускаем по очищаемой поверхности ток для усиления эффекта очистки. Далее к очищенному металлу автомобиля прикладываем «кусок из металла-Цинка» и пропускаем ток от Цинка к металлу авто. Ток начинает отрывать ионы цинка, и они прикрепляются к поверхности металла авто, таким образом образуется защитное, тонкое покрытие из цинка, которое первым «берёт на себя удар» окисления и последующей ржавчины. При этом цинк ржавеет намного медленнее чем сталь, чем хорошо защищает стальной кузов авто от ржавчины.
ЭТАП I. Очистка от ржавчины.
Для очистки от ржавчины протестировал следующие материалы:

1. Кальцинированная сода. В виде порошка. Цена 0,8$ (40р.).
2. Средство для чистки труб «КРОТ». В виде порошка, состоит из едкого натра (гидроксид натрия) который является щёлочью. Цена 0,3$ (20р.).
3. Средство для чистки труб «КРОТ». В жидком виде, состав то же едкий натр + антикоррозионная добавка. Цена 1,1$ (80р.).
4. Ортофосфорная кислота. Цена 6,7$ (400р.) за 1 литр.
5. Серная кислота. В виде электролита для свинцово-кислотных АКБ. Цена 1,0$ (60р.).
Чистка от ржавчины электролизным способом

Привет всем. О электролизном способе очистки заржавевших деталюшек слышали многие. Но, наверное есть и такие которые имеют слабое представление о этом крайне полезном действии, которое запросто заменяет щетку и пескоструйную обработку.
Вот есть у нас очень заржавленный, но ровный диск. Можно конечно было поработать над ним болгаркой с корщеткой часик-полтора, но я пошел путем для более ленивых — методом электролиза.
Для этого нужно:
1.Емкость для раствора — я приобрел большой тазик из резины (в принципе подойдет из любого диэлектрика)2.Вещество, водный раствор который будет электролитом — лучше всего сода, пищевая или кальцинированная, она не вызывает химических ожогов (как например щелочи) и легко отмывается, не способствует дальнейшей коррозии (как например поваренная соль, хлорид-ионы который потом сложно отмыть.3. Вода. Обычная из водопровода.
4. Источник ПОСТОЯННОГО тока. Лучше всего в пределах 12-24 вольт и с регулировкой и индикацией тока. Зарядное устройство или блок питания от компа подойдут.

Я использую старое ЗУ для аккумуляторных батарей на 20 А, с индикацией тока и напряжения и ступенчатой регулировкой.5. Положительный электрод-анод. Материалом для него лучше всего будет нержавейка. Если нет нержи, то на крайняк можно взять чернуху. Но электрод из обычной стали будет быстро растворятся.

Заливаем воду в сосуд. Делаем раствор. Сколько идёт соды на литр воды сказать сложно. Это зависит от формы детали, расстояния между электродами, напряжения. Я ориентируюсь по току. На тазик который я брал ушло около 600 г кальцинированной соды. Крепим «-» от источника на деталь (она у нас будет катодом). Способов есть куча. Можно струбциной ( со струбцины может облезть краска), можно болтом как я.Главное чтобы был хороший контакт. Опускаем деталь в раствор.
Крепим «+» от источника на анод. Анод, как я уже писал, лучше всего из нержавейки. Обычная сталь будет растворятся, но если нет под руками старой ненужной ложки/вилки или корыта от старой стиралки то на один раз пойдет и чернуха. Заметил, правда, что если использовать обычную сталь для анода, то на обрабатываемой детали оседает темный налет, который потом нужно смывать.